¿Qué son los puentes de hidrógeno?
En un lenguaje formal químico, un enlace
o puente de hidrógeno puede
ser definido como una fuerza electrostática atractiva, que se establece entre
un átomo electronegativo, con un átomo de hidrógeno que está
unido covalentemente a otro átomo electronegativo. Para muchos estudiantes,
la comprensión de este concepto puede resultar confusa, ya que se requiere de conocimientos
previos que el estudiante debe manejar, por lo que es importante revisarlos
brevemente para luego abordar con mayor propiedad el de puente de hidrogeno. Para tal fin, se explicará el referido
concepto, dentro del marco de las interacciones que establecen las moléculas de
agua entre sí, cuando éstas se encuentran en estado líquido o sólido.
Como es por todos conocido, las moléculas de agua
están formadas por dos átomos de hidrógeno unidos covalentemente a uno de oxígeno,
de allí su fórmula química general H2O. Como los estudiantes deben recordar,
el oxígeno, después del flúor, es el elemento con mayor electronegatividad presente
en los seres vivos, que mide la capacidad
de un átomo para atraer hacia su núcleo, solo aquellos electrones
que comparte con otros átomos en sus enlaces covalentes, cuando dichos átomos son
parte de una molécula.
Debido
a la mayor electronegatividad del oxígeno, con respecto a la del hidrógeno, la
molécula de agua presenta una estructura de dipolo eléctrico permanente (Figura
1). Ello significa, que en todo momento, las moléculas de agua poseen un lado
con una carga positiva y el otro lado con una carga negativa. Esta asimétrica distribución
de cargas, se debe a que el oxígeno atrae hacia su núcleo, los electrones de
los dos enlaces covalentes que éste forma con los hidrógenos. Dicha atracción,
deja parcialmente sin electrón el núcleo de los hidrógenos, cuya carga
positiva, debido a la presencia de un protón, queda ahora expuesta, razón que
determina su condición de dipolo permanente.
Además
de la elevada electronegatividad del átomo de oxígeno, otros factores que
contribuyen a la polaridad de la molécula de agua, son los electrones presentes
en los orbitales profundos del oxígeno, y los dos pares de electrones no
compartidos presentes en su capa de valencia. Hasta este punto, los elementos explicados
permitirán comprender mejor el concepto de puente de hidrógeno, definido en el
primer párrafo. En términos más precisos, dicho concepto expresa, que el hidrógeno
de una molécula de agua, con su carga positiva, es atraído por las cargas
negativas de los electrones no compartidos del oxígeno de otra molécula de agua,
para formar el respectivo puente de
hidrógeno (Figura 2).
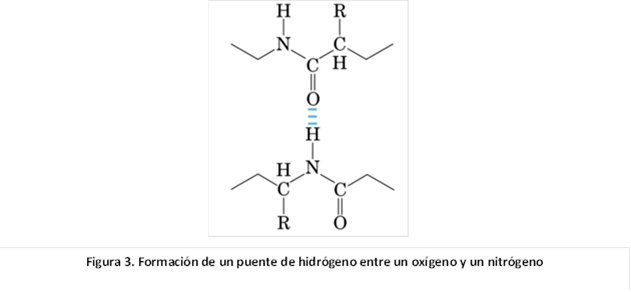
El nitrógeno es el otro elemento, junto con el
oxígeno, presente en los compuestos biológicos, con la electronegatividad
apropiada para formar puentes de hidrógeno (Figura 3). Dicha capacidad obedece
a las mismas razones que poseen las moléculas de agua, con la diferencia de que
con el nitrógeno, éstas son más reducidas. Ello se debe, a que este elemento es menos electronegativo que el oxígeno, y además
solo posee un par de electrones no compartido en su último orbital, que en
conjunto, restringe su capacidad para formar los puentes.
Este tipo de enlace es el que mantiene unidas a
las moléculas de agua a temperatura ambiente (25 °C). De no existir tales
interacciones el agua fuera un gas. Ello se hace evidente cuando se compara con
el amoniaco (NH3) y el sulfuro de hidrógeno (H2S), cuyas
estructuras son similares a la del agua, pero ambas sustancias son gases a
temperatura ambiente, por poseer limitadas capacidades para formar puentes de
hidrógenos.
Por otra parte, los puentes de hidrógeno ejercen
una profunda influencia sobre otras propiedades físicas del agua. Ellos son los
responsables de que ésta posea valores altos
de calor específico, de calor de fusión,
de calor de evaporización, de viscosidad, de constante dieléctrica, de conductividad
térmica, entre otras. En estado líquido, cada molécula de agua se asocia en
promedio, a través de estos enlaces, con otras 3,7 moléculas, y en estado
sólido con cuatro de ellas.
En términos energético es
importante destacar, que los puentes de
hidrógeno son interacciones débiles y
transitorias, con una vida media de aproximadamente 10-11 segundos o
menos. Su ruptura, en agua líquida, solo requiere alrededor de 4,5 Kcal/mol,
que representa menos del 5 % de la energía necesaria para romper un enlace
covalente entre un oxígeno y un hidrógeno. Si bien es cierto que
individualmente los puentes de hidrógeno son enlaces muy débiles, en conjunto, constituyen
una de las principales fuerzas que
sostienen y dan forma a las moléculas que forman a los seres vivos.
REFERENCIAS:
Berg, J.M., Tymoczko, J.L., Stryer, L. (2008). Bioquímica. Barcelona, España. Editorial Reverté.
Mathews, C. K., Ahern, K. G., Van
Holde, K. E. (2002). Bioquímica. Madrid, España. McGraw-Hill.
Murray, R. K.,
Bender, D. A., Botham K. M., Kennelly P. J., Rodwell, V.W., Weil, P. A. (2010).
Bioquímica Ilustrada de Harper. México, D.F. McGraw-Hill Interamericanas
Editores.
Nelson, D. L. y Cox, M. M. (2014).
Lehninger: Principios de Bioquímica. . Madrid,
España. Ediciones Omega, S.A.
Voet, D. y Voet, J. G. (2006). Bioquímica. Argentina. Editorial Médica Panamericana.
PROFESOR DE BIOQUÍMICA
Se dictan clases particulares de Bioquímica
por skype:
Contacto:
Teléfonos: + 584162026647
Teléfonos: + 584162026647
+ 582126715844
Correo: castrocaraballo@gmail.com






No hay comentarios:
Publicar un comentario